Özet Bu çalışma, İstanbul Bağcılar ilçesine bağlı Özel Güneşli Lisesi, birinci sınıflar üzerinde gerçekleştirildi. Uygulama konusu olarak öğrencilerin anlamakta zorlandıkları periyodik tablo konusu seçildi. Birinci yarıyıldaki başarıları birbirine yakın olan iki sınıf seçilerek, biri kontrol grubu diğeri deney grubu olarak belirlendi. Öğretimden önce, bilimsel işlem becerilerinin, bir konuyu anlamaya etkisini saptamak amacıyla, her iki gruba da, Bilimsel İşlem Beceri Testi uygulandı. Periyodik tablo konusunda, 20 soruluk bir Kavram Testi hazırlandı. Bu test, her iki gruba, öğretimden önce öğrencilerin bu konudaki ön bilgisini ölçmek amacıyla Ön Test, öğretimden sonra, başarıyı ölçmek amacıyla Son Test olarak uygulandı. Periyodik tablo' konusu, kontrol grubuna geleneksel anlatım yöntemi; deney grubuna, önerdiğimiz yeni yaklaşım ile işlendi. Sonuçlar, t-Testi ile değerlendirildi. Önerilen yeni yaklaşımın, geleneksel anlatım yöntemine göre daha başarılı olduğu saptandı. Anahtar Sözcükler : Periyodik tablo, periyodik tablonun liselerde öğretimi Giriş Günümüzde bilgi birikimi hızla artmaktadır. Bu kadar çok bilginin insana yüklenmesi, hem olanaksız hem de gereksizdir. Onun yerine, öğrenciye araştırma yapmayı ve öğrenmeyi öğretmek, dolayısıyla bilgiye ulaşmayı öğretmek gerekmektedir. Oysa, hâlen devam eden geleneksel öğretim sistemimiz, öğretmen merkezlidir. Üniversite sınavı gibi yarışmaların zorlaması ile kalıcı eğitim verme, zaman kaybı gibi görülmektedir. Oysa ezberlemek için yapılan tekrarlar için harcanan zaman, öğrenmek için harcanandan kat kat fazladır (Tezcan vd., 2003). Bir elementin özelliklerinin, atom numarasının periyodik bir fonksiyonu olduğu, ilk kez 1864'te, Mayer vd. tarafından açıklanmış, 1867-1869 yıllarında Mendeleev, 1912-1914 yıllarında Moseley tarafından geliştirilmiş ve bugün yaygın olarak kullanılan sistemin temeli atılmıştır (Gorin, 1996; Fernelius vd, 1982). Periyodik tabloda, elementlerin alt gruplarını tayin etmek için A ve B harflerinin kullanılmamasını, bunun yerine atomun elektron dizilişini gösteren s, p, d, ve f blokları hâlinde gösteriminin daha öğretici olduğunu önermişler ve buna uygun bir tablo vermişlerdir. Bu tablo Birleşik Amerika'nın birçok okulunda kullanılmaktadır. Osorio (1990), periyotları ikizkenar yamuk içine yerleştirdiği yeni bir sistem önermişse de, bu tablo karışık bulunmuş ve benimsenmemiştir. Jack (1985), yazarların yaptıkları yeni çalışmaları uyguladıkça, periyodik tablonun gruplarındaki gösterim farklılıklarının karmaşaya neden olduğunu, bu konuda bir anlaşma sağlanması gerektiğini vurgulamıştır. Campbell (1989), periyodik tablo anlatılırken periyodik olmayan bir tablonun kullanıldığını, bunun için duvar panoları yapılmasını önermiş, ancak bu öneri pratik olmadığından benimsenmemiştir. Strong (1986), bir elementin elektron konfigürasyonunu, periyodik tablodan kolayca anlayabilmek için, periyodik tabloyu, atomun en dış enerji seviyesindeki orbitalleri belirten s, p, d ve f blokları şeklinde göstermiş, her bloğu kendi içinde 1'den başlayarak, soldan sağa doğru numaralandırmıştır. Roger (1982), elementlerin elektron konfigürasyonlarını nasıl ve neden öğrenmemiz gerektiğini açıklamış; Lehman (1984), Jonurs (1982), Fernelius (1986) ve Leoning (1983) periyodik tablonun gösterimi ile ilgili çalışmalar yapmışlardır. Periyodik tablo, kimya öğretiminde çok önemli bir temeldir. Finley vd. (1982), lise öğretmenlerine 50 maddelik kimya konusunun sıralandığı bir anket uygulayıp, konuları önem sırasına göre numaralamalarını istediklerinde, periyodik tablo konusu, 4. sırada yer almıştır. Elementleri tek tek öğrenmek yerine, tablo iyi bilindiğinde, elementlerin özellikleri yorumla saptanabilir. Bu çalışmaya neden gerek duyuldu? Literatür özetinden görüldüğü gibi, periyodik tablo sunumu ve öğretimi için değişik görüşler vardır. Türkiye'de, okullarımızda, periyodik tablo, Moseley'in önerdiği gibi elementlerin atom numarasına göre dizildiği ve aynı özelliktekilerin alt alta geldiği belirtilip hemen uygulamaya geçilmektedir. Atom yapısı ve elektron dizilişi ile tablo ilişkilendirilmediği için, öğrenciler alt alta gelen elementlerin benzediğini bilir, ancak neden benzer özellikler gösterdiğini yorumlayamaz. Cetvelin özü kavratılacağı yerde, cetvelde yeri belli bir element için neler bilineceği cebir problemi çözer gibi kalıplandırılıp, bol alıştırma yapılır. Bu nedenle, öğrenciler lisede periyodik cetveli öğrenir, sınıfını geçer, hatta üniversite sınavlarını kazanarak kimya bölümlerine gelirler. Üniversitede, Temel Kimya' ve Anorganik Kimya' derslerinde elementin yeri biliniyorsa, yeri ile fiziksel veya kimyasal özellikleri arasında ilişki kurması istendiğinde, yorum yapamadığı görülmektedir. Örneğin, bir periyotta soldan sağa doğru gidildikçe elementlerin iyonlaşma enerjilerinin arttığını hemen tüm öğrenciler bilmekte, ancak sebebini izah etmeleri istendiğinde doğru cevap verememektedir. 4B grubundaki bir elementin değerliği sorulduğunda, hemen herkes +4 cevabını verebilir, ancak başka değer alıp almadığı veya nedeni sorulduğunda açıklama yoktur. Görülmektedir ki periyodik tablo daha derinlemesine verilmeli, ezberlemekten kurtarılmalıdır. Periyodik tablo öğrenimi ancak o zaman amacına ulaşmış olacaktır. White (1993)'a göre, öğrencilerin bir konuyu kavramasına etkiyen birçok faktör vardır. Bunlardan en önemlileri; ön bilgi, düşünme yeteneği, tutum, fiziksel ortam, ilgi ve ihtiyaçlar ve öğretim yöntemidir. Bizim bu çalışmamızda, öğretim yöntemlerinin periyodik tabloyu kavramaya etkisi araştırıldı. Bunun yanında ön bilgi, bilimsel işlem becerisi, cinsiyet faktörlerinin de öğrenmeye katkısı incelendi. Çalışmanın Amacı Problem: Öğrencilerin anlamakta zorlandığı periyodik tablonun, lise birinci sınıf öğrencilerinden bir sınıfa, liselerde şu anda uygulanmakta olan geleneksel anlatım yöntemi, diğerine önerdiğimiz yeni yaklaşım ile öğretim yaparak, iki yöntemin başarıya etkileri belirlenmiştir Alt problem olarak, öğrencilerin ön bilgilerinin, bilimsel işlem becerilerinin ve cinsiyetlerinin periyodik tabloyu kavramalarına etkileri belirlenmiştir. Metot Bu çalışmada bilinen, ancak liselerde uygulanmayan, periyodik tabloya elementlerin sıralanmasının, atomda elektronların orbitallere dizilişine paralel olarak verilmesine, veriş tekniği olarak, oluşturmacı yaklaşımdan ve Fernelius vd. (1982)'nin periyodik tabloyu atomun orbitallerine göre düzenlemesinden yararlanarak, bu üç sistemin senteziyle yeni bir yaklaşım oluşturulmasına, bu yeni yaklaşım ile geleneksel yöntemin başarıya etkilerinin incelenmesine çalışıldı. Örneklem Bu çalışma, 2000-2001 öğretim yılının ikinci döneminde İstanbul Bağcılar ilçesi Özel Güneşli Lisesi birinci sınıflar üzerinde gerçekleştirildi. Araştırmada 1. yarıyıldaki başarılarına göre, başarıları birbirine yakın iki sınıftan, biri deney grubu, diğeri kontrol grubu olarak belirlendi. Uygulamaya, deney grubunda 10 kız, 14 erkek olmak üzere 24 kontrol grubunda 9 kız, 17 erkek öğrenci olmak üzere 26, toplam 50 öğrenci katıldı. Deney grubuna önerdiğimiz yeni yaklaşımla; kontrol grubuna, liselerde uygulanan geleneksel anlatım yöntemi ile öğretim yapıldı. Öğretimden önce her iki gruba Bilimsel İşlem Beceri Testi (BİBT), periyodik tablo ile ilgili 20 soruluk Kavram Testi-Ön Test olarak (PTKT-Ö) öğretimden sonra periyodik tablo ile ilgili Kavram Testi Son Test olarak (PTKT-S) uygulandı. Sonuçlar t-Testi ile değerlendirildi (Büyüköztürk, 2002). Araştırma 6 haftada tamamlandı. Veri Toplama Araçları Bilimsel İşlem Beceri Testi (BİBT) Stuessy (1984) ve Onwuegbuzie (2000)'ye göre, öğrencilerin bilimsel işlem becerileri, bir konuyu anlamada etkili olmaktadır. Bizim öğrencilerimizde bilimsel işlem becerilerinin periyodik tablo konusunu anlamada etkisini saptamak amacıyla test, öğretimden önce her iki gruba uygulandı. Bu testin orijinali, Burns vd. (1982) tarafından geliştirilmiş, çevirisi Özkan vd. (1991) tarafından yapılmıştır. Test, 4 seçenekli çoktan seçmeli 36 sorudan oluşmuştur. Problemdeki değişkenleri tanımlayabilme (12), hipotez kurma, tanımlama (8), işlemsel açıklamalar getirebilme (6), problem çözümü için gerekli incelemelerin tasarlanması (3), grafik çizme ve yorumlama (4) yeteneklerini ölçen sorular bulunmaktadır. Testin geçerliliği yüksektir, tutarlılığı a=0,82 (KR 21 ) dir. Periyodik Tablo Kavram Testi (PTKT-Ö ve PTKT-S) Kavram testinin içeriği, lise birinci sınıf kimya müfredatından, çeşitli lise kimya kitapları ve periyodik tablo ile ilgili literatürlerdeki soru örneklerinden yararlanılarak hazırlandı. Test, dört seçenekli çoktan seçmeli (5), beş seçenekli çoktan seçmeli (15) soru olmak üzere toplam 20 sorudan oluşturuldu. Sorular; periyodik tablonun oluşumu, bir grup ve bir periyottaki elementlerine dizilişleri bakımdan ilişkileri, lantanit ve aktinitlerin cetvelde nerede bulunması gerektiği, bunların kendi içlerinde benzerliği ile aynı gruptaki elementlerin benzerliğinin kıyaslanması, s, p, d, f bloklarının yerleri nedeni, elementlerin değerliklerinin bulunması, periyodik tabloda yerlerinin saptanması, yeri belli elementin elektron konfigürasyonu ve atom numarasının bulunması, atom hacmi, iyonlaşma enerjisi, elektron ilgisi, elektronegativite, metalik-ametalik özellikler gibi, incelenen konuları içermesi sağlandı. Hazırlanan Kavram Testi'nin içerik geçerliliği, bu konuda deneyimli kişilerce incelendi, onaylandı. Güvenilirliği a=0,54 (KR 21 ) olarak bulundu. White (1993), Chandran vd. (1987 ), öğrencilerin düşünme yeteneği ve ön bilgilerinin bir konuyu öğrenmede çok etkili olduğunu açıklamışlardır. Hazırlanan kavram testi, öğrencilerin ön bilgilerinin periyodik tablo konusunu anlamadaki etkisini belirlemek amacıyla, öğretimden bir hafta önce, ÖN-TEST olarak uygulandı. Test, öğretimden sonra SON-TEST olarak uygulandı. Böylece ilk testteki başarı ile son testteki başarıyı karşılaştırarak, her iki gruptaki başarı artışını saptama ve yöntemlerin başarıya etkilerini karşılaştırma amaçlandı. İşlem Periyodik tablo öğretiminde asıl problem, öğrencinin periyodik tabloyu özümleyerek iyi öğrenemeyişi, elementlerin tüm özelliklerini tablodaki yerine bakarak yorumlayabilecek bir öğretim uygulanamayışıdır. Bu çalışmada öğretim, geleneksel anlatım yöntemi ve yeni yaklaşım ile gerçekleştirildi. Her iki gruba, öğretimden önce BİBT ve PTKT-Ö, öğretimden sonra da PTKT-S uygulandı. Öğretim her iki gruba da aynı öğretmen tarafından uygulandı. Böylece, öğretim yaklaşımları dışındaki koşullar eş tutularak, başarıdaki farkın, yalnızca öğretim yaklaşımından kaynaklanması sağlanmaya çalışıldı. Öğretim sonunda yapılan periyodik tablo kavram testi sonuçları değerlendirilerek iki yöntemdeki başarı durumları karşılaştırıldı. Kontrol Grubu: Geleneksel Anlatım Yöntemi Türkiye'de, liselerimizde genellikle bu yöntem kullanılır. Geleneksel anlatım modelinin ilkeleri, Ausubel'in sunuş yoluyla öğretim, Gagne'nin (1985) öğretim etkinlikleri gibi önerilen öğretim görüşlerini içerir . Rosenshine'e (1987) ve Senemoğlu (1998)'na göre, geleneksel anlatım yöntemi öğretmen merkezlidir. Öğrenciye sunulacak bilgi materyalinde, bilginin sunumunda öğretmen etkindir. Öğretimin işleyişi, öğretmenin kontrolündedir. Öğrenciye kazandırılacak hedefler, hedeflere ulaştıracak etkinlikler, etkinlikler için ayrılacak zaman belirlidir. Öğrencinin performansı izlenir, öğrenciden anında dönüt alınarak yönlendirilir. Sonuç olarak, öğrenci dinleyici, istendiğinde bu bilgileri verici konumundadır. Araştırmacı derse girmeden önce derse girişi nasıl yapacağını, konuyu nasıl anlatacağını, ne gibi örnekler vereceğini, nerde hangi soruları soracağını planladı. Ders kitaplarındaki bilgileri bir plan dahilinde anlattı. Her dersin sonunda konuyu toparladı. Öğrencilere anlamadıkları yer olup olmadığını sordu ve soru varsa yanıtladı. Bir sonraki konuyu belirtip, konuya hazır gelmelerini isteyerek dersleri bitirdi. Ders işlenişi: Lise kimya kitabında (Karaca, 2002) verilen bilgiler, bilim adamlarının önerileri doğrultusunda işlendi. Deneysel Grup: Önerilen Yeni Yaklaşım Bu çalışmada, periyodik tablo öğretiminde önerilen yeni yaklaşım şöyle tasarlandı: Elementlerin tabloya, bilinen, ancak liselerde uygulanmayan, elementlerin elektron dizilişine göre sıralanacak ve aynı özelliktekiler alt alta gelmesi sağlanacaktır. Aynı anda sınıf tahtasının bir köşesinde elektron dizilimi gösterilen element, diğer köşede oluşturulan periyodik tabloda yerine yerleştirilecektir. Böylece öğrenciler elementlerin özelliklerinin atomun dış katmanındaki elektron sayısına ve orbitallerdeki dizilişine bağlı olduğunu, benzer orbitallerde benzer elektron dizilişine sahip olan atomların, neden birbirine benzediği gerçeğini gözleri ile görmüş olacaklardır. Her element tabloya yerleştirildiğinde bir üstüne rastlayan elemente neden benzediğini ve hatta benzemiyorsa neden benzemediğini, öğrencinin bizzat kendisi yaparak fark edecektir. Bu nedenle 1. periyotta H' den sonra gelen He'un 2. periyotta sıralandıktan sonra neden Ne'nun üstüne çekilmesi gerektiğini öğrenci görebilecektir. Diğer taraftan periyodik tablo Fernelius vd. (1982)'in tabloyu s, p, d ve f blokları hâlinde gösterimi benimsenmiş, grupları gösterim şekli benimsenmemiş, tablo s, p, d ve f blokları hâlinde verilmiş, ancak gruplar A ve B harfleri ile gösterilerek dış enerji katmanı ile alt kabukların kolaylıkla ayırt edilmesi sağlanmıştır. Elektron dizimi, tabloya yerleştirilmesi aşamasında öğretmen öğrenciyi bilgilendirmiş ancak uygulamayı tamamen öğretmen rehberliğinde öğrenci gerçekleştirmiştir. Elementlerin yerleştirilmesinde alt alta gelen elementlerin benzerliği tartışmasında bazen karşıt görüşler ortaya atılmış, bu durumda öğretmen doğru cevabı söylemek yerine yönlendirici sorular yönelterek konuya yönlenmelerini sağlamış, birbirlerini kanıt göstererek ikna etmelerini istemiş ve doğruyu kendilerinin bulmalarını beklemiştir. Sonuç olarak elektron dizilişinden, Fernelius vd. (1982)'nin önerilerinden ve oluşturmacı yaklaşımdan faydalanak yeni bir uygulayış şekli türetilmiştir. Oluşturmacı yaklaşımdan, Bodner vd. (2001), Driver vd. (1986) gibi bilim adamlarının oluşturmacı yaklaşım hakkındaki görüşleri analiz edilerek yararlanmaya çalışılmıştır. Yager'e (1991) göre bir şeyi bilmek, onun nasıl yapılacağını bilmek demektir. İnsan bir şeyi izah edebiliyorsa biliyor demektir. Postner vd. (1982), öğrenciler eğer yeni bir kavramı anlaşılır, kabul edilebilir ve faydalı bulurlarsa, bu yeni kavramı kavrayabilirler. Bizim bu çalışmamızda konu öğretimi bu görüşler doğrultusunda gerçekleştirilmeye çalışılmıştır. Şöyle ki: Tahtanın yanına, atomda elektron diziliş sırasını gösteren, kartona hazırlanmış büyük tablo asılmıştır. Tahta yeterli büyüklükte olduğundan, bir tarafında numara sırasına göre elementin elektronları dizdirilirken, diğer tarafta elementler numara sırasına dizdirilerek tablo hazırlanmıştır. Tek tek elementin elektron dizilişi gösterilip her defasında bu element üstteki hangi elemente benzemeli, neden yorumu yaptırılmıştır. 3. periyotta , elementlerin atom numarası artışına göre sıralandığında, kendiliğinden, bir üstüne rastlayan (2. periyottaki) elemente benzediği söylenip, bunun nedeni öğrenciye yorumlattırılmıştır. 4. periyotta, 3. elementin neden üstteki 3. elemente benzemediği, benzemeyen element sayısının neden 10 tane olduğu, bu 10 elementten sonra neden benzerliklerin yeniden başladığı, bunların nasıl düzenlenmesi gerektiği öğrenciye yorumlattırılmıştır. 5. periyotta neden tamamen 4. periyoda benzediği tartışılmıştır. 6. periyot , ilk üç elementten (La) sonra gelen 14 elementin, neden birbirine benzediği, (Bu arada orbitallerle ilgili değerlik yorumu öğretmen tarafından verildikten sonra) bu elementlerin tümünün arka arkaya değil de, aynı kutu içine yazılacak kadar birbirine benzemesinin nedenleri tartıştırıldı. Bu elementleri tabloya yerleştirmek için, lantanitler adı verilerek cetvelin altına alınışı, yorumlatıldı. 7. periyot öğretmen tarafından hiç açıklama yapılmaksızın, tamamen öğrenciye dizdirildi ve yorumlattırıldı. Gruplar, alışılan tarzda s, p blokları A, d bloğu B ile gösterildi ve f blokları alta yerleştirildi. Böylece bir elementin tablodaki grup numarasının, atomun en dış katmanındaki toplam elektron sayısını vermesi sağlanmış oldu. Sonuçta s, p, d, ve f. blokları ile tablo oluşturmaları istendiğinde, konunun kavrandığı görüldü. Dersten Bir Kesit Giriş : Elementleri tek tek öğrenmenin ne kadar çok zaman alacağı, bellekte tutulmasının gereksiz ve imkânsız olduğu, elementleri daha kolay öğrenmek için eskiden beri sınıflandırma yoluna gidildiği, bu nedenle ilk sınıflandırmada elementleri iki sınıfa ayırmak suretiyle, metal-ametal dendiği (tahtada şema yapıldı), ancak bazı elementlerin her iki grubun da özelliğini taşıdığı gibi (yarı metal) aynı sınıftakilerin bile çok farklı olduğu (Hg ve Cu, Au gibi günlük hayatta karşılaştıkları elementler örnek verilerek) vurgulanıp daha ayrıntılı bir sınıflandırmaya gerek olduğu söylenerek giriş yapıldı. Bu konuda Mendelyev- Mosesley'in tabloyu önce atom ağırlığına, sonra atom numarası na göre oluşturduğu ancak, elementlerin tüm özelliklerinin atomun dış katmandaki elektron sayısına, dolayısıyla elektron dizilişine bağlı olduğu, öyleyse elementleri elektron dizilişine göre sıralamanın daha açıklayıcı olacağı belirtilip, öğrencilerin bunu algılamaları beklenerek derse devam edildi. Nötr bir atomda, atom no = p sayısı = e. sayısı hatırlatıldı, e diziliş tablosuna dikkat çekildi. Öğretmen en küçük atom numaralı element olan H' den başlayarak ilk üç elementin e. dizilişini tahtaya yazdı. Tahtanın öbür tarafına tablo yapmak için yeterli alan belirleyerek, bu üç elementin nasıl sıralanması gerektiğini öğrencilere sorarak tahtaya sıraladı (Metinde bundan sonra elektron=e olarak gösterilecektir). 1 H : 1s 1 Helyumdan sonra gelen Li atomunu aynı şekilde He'un sağına koydu ve şu açıklamayı yaptı: Li'un bazı özellikleri H'e benzer. Örneğin her ikisi ametallerle bileşik yapar ve bileşiklerinde her ikisi de +1 değerliklidir. Bizim tablo oluşturmada kabullerimizden biri, e sayısı arttıkca, elementi bir sağa yerleştirmek, diğeri benzer özelliktekileri alt alta getirmekti. Öyleyse Li'u H'in altına alıyorum.( Li, H'in altına yazılır). Öğretmen, sınıfa neden bu iki elementin benzer özellik göstereceğini sordu ve açıklamaları için zaman verdi. Bazı öğrenciler, önceki bilgilerine dayanarak, Li'un metal, H'in ametal olduğunu gerekçe göstererek, ikisinin benzemediğini savundular. Bazıları da son katmandaki e dizilişinin aynı olduğunu görerek benzer olacağını savundu. Öğretmen doğru cevabı söylemedi ve birbirlerini kanıt göstererek ikna etmelerini istedi. Sonuçta öğretmen sınıftan şu cevabı aldı: Li elementinin e dağılımı ( 1S 2 2s 1 ), H'in e dağılımı (1s 1 ) dir. Elementlerin özellikleri, dış katmandaki e sayısına ve dizilişine bağlı olduğuna göre, her ikisinin de s orbitalinde bir e. var. Öyleyse özellikleri benzemelidir. Li, H'in altına yerleştirilebilir. Böylece, lityum ile 2. sıra elementleri başlatıldı. Öğretmen: Li'dan sonra Be atomu geldiğini, fakat Be'un özelliğinin He'un özelliğine benzemediğini söyledi, nedenini açıklamalarını istedi. Bir öğrenci Be'da 2s 2 ile He'a benzer gibi görünüyor ancak, 2. katmandaki 2ppp orbitalleri boş. Bu katman henüz dolmamış, hâlbuki He'da boş orbital yoktur, 1. katman tamamen doludur cevabını verdi. Diğerleri bunu hemen kabul etti. Öğretmen sıralamaya göre Be'u, Li'un sağ tarafına yazalım, bakalım ileride ne göreceğiz? dedi ve No 5-11 arasındaki elementlerin e dizilişini defterlerine yazmalarını ve tabloya yerleştirmelerini istedi. Öğretmen aralarda gezerek yapılanları denetledi. Bir öğrenci kaldırılarak tahtaya yazdırıldı. 3 Li : 1S 2 ,2S 1 Burada öğretmen iki konuya dikkat çekti. Birincisi Na'un dış katmanındaki e dizilişinin üstteki hangi elemente benzediğini buldurdu. Dolayısıyla Na 2. sırada değil 3. sıranın başına alındı. İkincisi Ne atomu ile He atomunun e dizilişlerini karşılaştırmalarını istedi. Bazı öğrenciler en dış katmanın tam dolu olduğunu hemen gördüler. Öğretmen burada bir atomun dış enerji katmanı tam dolu ise atomun küresel simetriye erişmiş olduğunu, bu konumda çekirdeğin e'ları çekiminin en fazla olduğunu, çekim fazla olunca da atomun büzüşerek dış katmanın çekirdeğe yaklaşacağını, katman çekirdeğe yaklaştıkça da enerjisinin düşeceğini, bu nedenle böyle elementlerin, olabilecek en kararlı hâlde olduğunu açıkladı.(Aslında bu açıklama atomun yapısı konusunda öğretilmişti. Ancak bazı öğrencilerin tam kavramadığı görülerek, tahtaya model çizilerek ve el ile kürenin büzüşmesi gösterilerek büzüşme tasarlatıldı.) He ve Ne, en kararlı elementler olmalı. Bu tür elementlere bundan sonra soygazlar diyelim bilgisini verdi. Benzer atomların alt alta geleceğini, Ne'nun He'un altına yazılamayacağını, çünkü Ne ile Li arasında element olduğunu, öyleyse nasıl bir çözüm önereceklerini sordu. Sınıftan kısa bir tartışmadan sonra He'un, Ne'un üstüne çekilebileceği cevabı alındı. H ile He arasının boş olduğu, burada başka element olup olamayacağını sorup atom numaralarının 1, 2 olduğu arada element olmadığı tekrar teyit ettirildi. (Böylece 4 sırada, sağa kaydırılarak d orbitallerinin üstünün boşaltılmasına da, hazırlık yapılmış oldu.) 1 H 2 He 3. Sıra : Öğretmen şimdi atom numarası 12-18 arasındaki elementlerin e dizilişini yazmalarını ve tabloya yerleştirmelerini istedi. Na'dan sonra gelen elementlerde, her element bir sağa yazıldığında, kendiliğinden bir üstteki elemente benzediğini söyleyip, bu uyumun nedenini tartışmalarını istedi. Öğrenciler e. dizip tabloya yerleştirdiler ve her elementin dış katmanındaki e. dizilişinin, bir üstteki element ile aynı olduğunu fark edip, benzerliği açıkladılar. 11 Na : 1s 2 ] 2s 2 2p 6 ] 3s 1 3ppp s ve p orbitallerinde değerlik: (Atomun yapısı bölümünde işlenen değerlik kavramı öğretmen tarafından tekrarlandı.) Bir atomun temel hâldeki elektron dizilişinde yer alan orbitallerden en yüksek enerji düzeyindeki orbitallere değerlik orbitalleri, değerlik orbitallerinde bulunan elektronlara değerlik elektronları, e. sayısına da değerlik elektron sayısı dendiği belirtilip, buraya kadar sıralanan elementlerin alabileceği değerlikler tek tek bulduruldu. Defterlerinde ve tahtada e. dizilişi hazır bulunan her elementin sol yanına, değerlikleri yazdırıldı, nedeni tartışıldı. Böylece s ve p orbitallerinin değerliğe katkısı tekrarlanmış oldu. 4. Sıra: Şimdi öğretmen No 19-21 arasındaki elementlerin e dizilişini ve tabloya yerleştirilmesini istedi. 19 K ve 20 Ca'un e. ları orbitallere dizdirilip tabloya yerleştirdikten sonra, sıranın 3. elementi olan, 21 Sc'un tabloda üstüne rastlayan B ve Al'a benzeyip benzemediği, bunun nedenini tartışmaları ve bunu takip eden kaç tane elementin, kendi üstüne rastlayan elemente benzeyemeyeceğini bulmalarını istedi. Tartışmaya açtığını söyledi ve belirli bir süre verdi. Burada atomun yapısını iyi bilen birkaç öğrenci, No 21 ile başlayan elementten sonra gelen 10 elementin elektronlarının, d orbitallerine dizildiğini, dolayısıyla da, üstüne rastlayan p orbitaline e dizilen elementlere benzeyemeyeceğini yorumladılar. Sınıfın tamamı durumu fark edene kadar tartışmalarına izin verildi. Ayrıca bu elementlerden sonra gelen Ga'un, üst sıralarda, baştan 3. element olan B ve Al'a neden benzediği, Ga ve takip eden toplam 6 elementin de neden üstüne rastlayan diğer p bloğu elementlerine benzediği, öğrencilere bulduruldu. Elektron dizilişi: Şimdi Ga'un B ve Al'un altına yazılabilmesi ve tablonun anlamlı olabilmesi için Ca'dan sonra gelen 10 elementin ( 21 Sc, 22 Ti, 23 V, 24 Cr, 25 Mn, 26 Fe, 27 Co, 28 Ni, 29 Cu, 30 Zn), üstü boş kalacak şekilde, yani B ve Al; Ga'un üzerine gelecek şekilde sağa kaydırıldı. (1. sırada He'un Ne üstüne çekilmesi benzerliği hatırlatıldı). 1 H 2 He 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr d orbitallerinde değerlik: Burada öğretmen tarafından d orbitallerine e. dizilen elementlerde değerliklerin nasıl saptanacağı verildi. d orbitallerine e. bir dış katmanın s orbitalinden sonra doldurulduğu, ancak e. girdikten sonra orbitallerin kendi katmanına, dolayısıyla, bir iç katmana çekildiği hatırlatıldı. Örneğin e diziliş sırası 4s, 3d olduğu hâlde 3d'ye e. girdikten sonra 3d'nin kendi katmanına yani 4s'nin içine çekileceği, sıralamanın 3d, 4s olduğu gösterildi. e. en dıştan başlayarak ayrılabileceği için önce en dış katmanda, 4s orbitalinde bulunan iki e' yi verip +2 değerlik alacağı, biraz daha etkin koşul sağlandığında, bir içe çekilmiş bulunan 3d orbitallerindeki e'ların verilip, 4s ile beraber toplam e sayısı kadar (+) değerlik alacağı, bu da grup numarası kadar (+) değerliği verdiği açıklandı. Daima (+) değerlik alacağı için metal oldukları, bu metallere geçiş metalleri' adı verildiği açıklanıp, elementlerin değerlikleri ile ilgili çeşitli örnekler yaptırıldı. Sc, Ti, V, Cr, Mn'un değerlikleri hesaplattırıldı. Fe, Co, Ni'in değerlikleri bu kural dışında (ileride öğrenecekleri belirtilip) genellikle +2, +3 değerlikleri aldıkları belirtildi. 1B ve 2B deki elementlerin (Cu ve Zn) değerlikleri öğrenciye bulduruldu. (Burada Cu'nun değerliği yorumunda yarı küresel simetriden ve bu konumun tam küresel simetriden sonra en kararlı hâl olduğuna dikkat çekildi.) Bir öğrenci tarafından; Cu:----- 3d 1 d 1 d 1 d 1 d ,4s 2 yerine----- 3d 1 d 1 d 1 d 1 d 1 4s 1 olabileceği yarı küresel simetri oluşumunun kararlılığı ile bağdaştırıldı. 5. Sıra: Rb ile başlatıldı. Her elementin, kendinden önceki elemente göre, bir sağa yazıldığında, kendiliğinden üsttekilere benzediği tamamen öğrenciye yorumlatılarak, (orbital türü ve orbitaldeki e. sayıları) tüm 5. sıra elementleri tabloya dizdirildi. Öğrencilerin burada hiç zorlanmadığı, 3. sıranın 2. sıraya benzediği ilişkisini hemen kurduğu görüldü. 1. H He 55 Cs ile başlayan 6. sıra elementlerinin e'ları, bir öğrenci tahtada olmak üzere, öğrencilere yerlerinde dizdirildi. (Burada artık e. dizilişini, zamandan kazanmak ve karşılaştırmaların daha kolay yapılması bakımından, kısaltma yoluna gidilebileceği, öğretmen tarafından belirtildi. Şöyle ki, her elementte, kendinden bir önceki soy gazın sembolünü yazmakla, buraya kadar olan e. dizilişini göstermiş olduğumuz belirtilip, sadece soy gazdan sonrasını dizmenin, yani yalnızca dış katmanı göstermenin yeterli olduğu hatırlatıldı.) ------------ Öğrencilerden No 55-72 arasındaki yukarıdaki elementlerin periyodik cetvele yerleştirmeleri istendi. İlk üç element yerleştirildikten sonra, 4. element olan 58 Ce'da kararsız kaldıkları görüldü. Son e. nun 4f doldurulması nedeniyle, tabloda sağ tarafa yazıldığında, Ti ve Zr'ye benzemediği fark edilinceye kadar tartışmaları sağlandı. Ancak nereye yerleştirecekleri hakkında kararsız kaldılar. 4f orbitaline e. doldurulan bu 14 elementin üstte benzeri olup olmadığına dikkatleri çekilip, tablo düzenlenmesinde, ne düşündükleri soruldu. (f. bloğu elementlerin değerlikleri açıklandı. f orbitaline e. girdiğinde kendi bölgesine, yani iki katman içe çekildiği, bunun dışında 5. katman tam dolu olduğu için ,küresel simetrinin kolayca yarılıp, iki iç katmanın f orbitalinden e. kopamıyacağı, dolayısıyla, f orbitali e. larının, değerliğe katkısının olmadığı açıklandı. Bu nedenle 14 elementin değerlik e. sayısının, La gibi olduğu, yani değerliklerinin 5d 1 6s 2 deki e. ları sırasıyla verip,+2, +3 değerlik alacağı açıklandı.) Alıştırma yapılarak konu pekiştirildi. Şimdi, yerleştirme için ne düşündükleri sorulduğunda sınıfın yarıdan fazlası d blok elementleri gibi sağa doğru sıralamaya devam edip üstteki d bloğu elementlerini sağa yani d blok elementlerinin üstüne çekmeyi önerdi. Bir kısmı ise mademki e. dizilişi La'nın aynı, öyleyse özellikleri de tamamen La'a benzemeli, bu nedenle de La'dan ayrı yazamayız, La'nın kutusuna yazılmalı ki, La ve bir üstündeki elementlere benzediği belirtilebilsin diyecek kadar e dizilişi ile özelliği bağdaştırdığı görüldü. La hanesine tümünü sığdırmak mümkün olamayacağı için bu 14 elemente lantanitler adı verilerek cetvelin altına alınmasının uygun olduğu sonucuna varıldı. Lantanitlerden sonra atom numarası 72 olan hafniyum (Hf) elementini (Ti ve Zr) atomlarının altında gösterebilir miyiz? Bu elementlerin değerlik e sayıları kaçtır? 4.sırada 22 Ti: [Ar] 18, 4s 2 3d 1 d 1 dddd 4ppp Öğrencilerden yukarıdaki üç elementin elektron dağılımı da d 2 ile bitmektedir, öyleyse birbirine benzemelidir yorumu alındı. Hf ve bundan sonra gelen 5d elementlerinin e'ları dizdirildi ve periyodik tabloya yerleştirilmeleri sağlandı. 7. Sıra: Öğretmen 87 Fr ile başlatılıp 103 no'lu elemente kadar e. larını dizip tabloya yerleştirmelerini istedi. Öğrenciler 89 Ac'a gelindiğinde aynı 6. sırada olduğu gibi. 7s 2 6d 1 Ac'den sonra gelen 14 elementte e'ların 5f orbitallerine dolduğunu, e. girdikten sonra iki iç katman olan 5 katmana çekileceği için, 6. katman da tam dolu ve küresel simetride olduğundan, 5f den e sökülemeyeceğini, değerliklerinin Ac'nin gibi, 6d 1 7s 2 sırasından e sökülerek +2 ve +3 değerlikli olacağını yorumladılar. Öğretmen burada hiç katkıda bulunmadı. Bu elementlere aktinitler adı verileceğini bile (hangi elemente benzediğini sorarak ) öğrenciye buldurdu. Yerleşim yeri, Lantanitlere benzetilerek öğrenciler tarafından saptandı. Sonuçta bugün kullanmakta olduğumuz modern periyodik tabloya benzer bir tablo oluşturuldu. s ve p orbitali elementleri A, d orbitali elementleri B ile gösterildi. Ancak d bloku elementleri 8 değil 10 grup olarak gösterildi. Böylece gurup sayısı, orbital sayısına bağlı olarak 10 tane B grubu işaretlenmiş oldu. Öğretmen periyodik tabloyu s, p, d ve f bloğu olmak üzere 4 blokta göstermelerini istedi. Kendisi sıra aralarında dolaşarak kontrol etti.Tüm öğrenciler Şekil 1'i defterine çizdi.
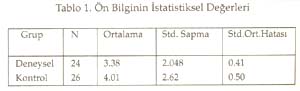
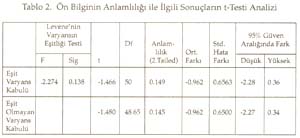
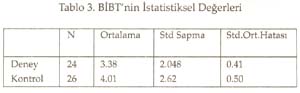
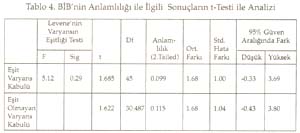
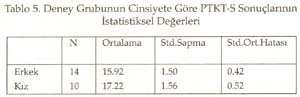
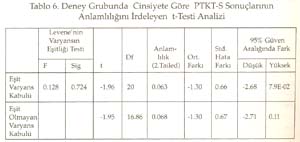
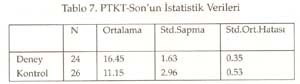
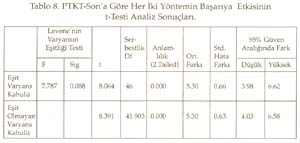
Periyotlar ve gruplar: Periyodik tabloyu değerlik kabuğundaki elektron dizilimine göre oluşturduğumuz tekrarlanarak, düşey sıralara grup , yatay sıralara periyot adı verildiği söylenip, grup ve periyotları işaretlemeleri istendi. Periyodik tablonun s bloğunda 1A, 2A; p bloğunda 3A, 4A, 5A, 6A, 7A, 8A; d bloğunda sırasıyla 3B, 4B, 5B, 6B, 7B, 8B, 9B, 10B, 1B ve 2B grupları yer aldığına göre, toplam 18 grup, 7 periyottan oluştuğu belirlendi. B grupların, neden 1B değil 3B ile başladığı yorumlattırıldı. Sadece grupların ve grup adlarının yazıldığı bir tablo hazırlattırıldı. Gruplara orbital türü ve aldığı e sayıları yazdırıldı Aynı şekilde sadece periyotları ve periyotların alabildiği element sayılarını gösteren bir tablo hazırlattırıldı. Her periyot içine atomda periyodun karşılığı olan enerji katmanındaki orbital türleri yazdırıldı. Elementlerin değerlikleri: ( Değerlikler daha önce tartışılmıştı.) Öğretmen elementlerin yalnızca değerlik orbitallerini, değerlik e. larını ve alabilecekleri değerlikleri gösteren bir tablo yapmalarını istedi. Burada biraz kararsız kalındığını görerek ilk 3 grubu (1A, 2A, 3B) kendisi yazarak tabloyu başlattı. Öğrencilere devamını onların yapması gerektiğini, önce kendi defterine yapmalarını istedi. Sonra da bir öğrenci kaldırılarak, tahtada sınıfın katkısı ile aşağıda görülen değerlik tablosu oluşturuldu. -------------------------------------------------------------------------- Bir elementin periyodik tabloda yerinin bulunması: Elektron dizilişi bilinen bir elementin tablodaki yerini saptayalım: Örnek olarak atom numarası 17 olan elementi alalım. Atomun e. dizilişini yapınız ve grup ve periyodunu saptayınız: X 17 : 1s 2 ] 2s 2 2p 6 ] 3s 2 3p 2 p 2 p 1 En dış katman 3. katman, öyleyse 3 periyotta. Dış katmanda 7 e var ve son e lar p orbitallerine yerleşmiş, öyleyse 7A grubunda cevabı sınıftan, başarı ile alındı. Bunu takiben s, d, f bloğu elementlerinden örnekler yaptırıldı. Tablodaki elementlerin değerlikleri, atom çapları, elektron ilgileri, elektronegatiflikleri ve bunların sonucu olarak metal, ametal oluşları öğrencilere yorumlatılarak her biri için bir tablo oluşturmaları sağlandı. Yeterli alıştırma yaptırıldı. Bir örnek alıştırma: X ile Y aynı grupta, X ile Z aynı periyottadır. Bulgular Bu çalışmada veri analizlerinde, anlamlılık derecesi a=0.05 alındı. Her iki örneğin (sınıfın) sayısı 30'dan az olduğu için t-Testi kullanıldı. İstatistiksel analizler SPSS (Statistical Package for Social Science) programı ile yapıldı. Ön Bilginin Analizi Tablo 1. Ön Bilginin İstatistiksel Değerleri Tablo 2. Ön Bilginin Anlamlılığı ile İlgili Sonuçların t-Testi Analizi Tablo 1'de görüldüğü gibi PTKT-Ö sonuçlarının ortalamaları, deney grubunda 3.38, kontrol grubunda 4.01 bulundu. Tablo 2'de öğretimden önce her iki grubun öğretim öncesi bilgileri arasında istatistiksel olarak anlamlı bir fark bulunmadı. Ön bilgileri eşit olan iki grupla öğretime başlanmış oldu. Bilimsel İşlem Becerileri ile İlgili Verilerin Analizi Tablo 3. BİBT'nin İstatistiksel Değerleri Tablo 4. BİB'nin Anlamlılığı ile İlgili Sonuçların t-Testi ile Analizi Tablo 4'te görüldüğü gibi, Levene'in varyans eşitliği 0.5'in altındadır. Yani, varyanslar eşit değildir. Öyleyse tablonun 2. satırındaki veriler dikkate alınmalıdır. t değeri 1.622, serbestlik 30.487, anlamlılık düzeyi 0.115, yani 0.05'in üzerindedir. O hâlde, her iki grubun bilimsel yeterlikleri 0.05 önem düzeyinde eşittir. Sonuç olarak, her iki grubun bilimsel işlem yeterlilikleri arasında anlamlı bir fark yoktur. Cinsiyetin Konuyu Kavramaya Etkisinin Analizi Tablo 5. Deney Grubunun Cinsiyete Göre PTKT-S Sonuçlarının İstatistiksel Değerleri Tablo 6. Deney Grubunda Cinsiyete Göre PTKT-S Sonuçlarının Anlamlılığını İrdeleyen t-Testi Analizi Tablo 6'da görüldüğü gibi varyansların eşitliliği 0.5'in üstünde olduğu için eşit varyans kabulü yapılacaktır. Bu durumda anlamlılık düzeyi 0.05in üzerindedir (yani 0.063). Sonuç olarak cinsiyetin periyodik cetvelin anlaşılması üzerine anlamlı bir etkisi yoktur. Yeni Yaklaşımın ve Geleneksel Yöntemin Başarıya Etkilerinin Analizi: Yöntemlerin başarı sonuçları Tablo 7 ve 8'de verildi. Tablo 7. PTKT-Son'un İstatistik Verileri Tablo 8. PTKT-Son'a Göre Her İki Yöntemin Başarıya Etkisinin t-Testi Analiz Sonuçları. Tablo 8'den anlaşıldığı gibi, Levene'in varyans eşitliği testi sonuçlarına göre anlamlılık değeri (1. satırda) 0.05'in altındadır. Bu, varyansların eşit olmadığı, 2. satırdaki değerlerin alınacağı anlamına gelir. İkinci satırda, t-değeri 8.391, serbestlik derecesi 41.903, anlamlılık düzeyi 0.00'dır. Öyleyse iki yöntemin not ortalamaları eşit değildir ve deney grubunun not ortalaması, kontrol grubundan anlamlı derecede yüksektir. Sonuç olarak önerilen yeni yaklaşım, geleneksel yönteme göre, istatistiksel olarak anlamlı derecede daha başarılı olmuştur. Sonuç ve Tartışmalar Ön Bilgi Testi (PTKT-Ö) sonuçları her iki grup arasında anlamlı bir fark bulunmadığını göstermiştir. Öyleyse öğrencilerin başarıları, ön bilgilerinden bağımsızdır. Her iki grubun BİBT sonuçları arasında anlamlı bir fark bulunmadı. Öyleyse bilimsel işlem becerileri bakımdan eş iki gruba öğretim uygulanmış, başarının yönteme bağlı olması daha netlik kazanmıştır. Ancak test sonuçları tek tek incelendiğinde, BİBT puanı yüksek olan öğrencilerin PTKT-S puanı da yüksek olduğu görüldü. Bu durum Stuessy (1984) ve Onwuegbuzie (2000)' in görüşleri ile uyumludur. Bilimsel işlem becerileri, konu kavramaya olumlu katkı sağlamıştır. Cinsiyetin periyodik tablo konusunu anlamada bir etkisi olmadığı saptandı. Öyleyse öğrencilerin başarıları, cinsiyete bağımlı değildir. Konunun içeriği gereği cinsiyete bağlı olmaması beklenen bir sonuçtur. Tablo 8 'de görüldüğü gibi, periyodik tablo öğretiminde önerilen yeni yaklaşım, geleneksel yönteme göre daha başarılı olmuştur. Öğretime başlama koşulları olarak, ön bilgi başarıları aynı, bilimsel işlem beceri sonuçları aynı, ders işleyen öğretmen aynı, tek değişken öğretim yöntemidir. Öyleyse önerilen yöntem, geleneksel yönteme göre başarılı olmuştur. Alınan sonuçlar; Postner vd. (1982)'nin, öğrenciler eğer yeni bir kavramı anlaşılır, kabul edilebilir ve faydalı bulurlarsa bu yeni kavramı kavrayabilirler, Yager'in (1991) eğer bir kavram kullanabiliyorsa öğrenme gerçekleşmiş demektir görüşlerini doğrulamıştır. Öğrenci e. dizilişi ile özellik arasındaki ilişkiyi kendisi özümlemiş, bunu faydalı, mantıklı bulmuş, üstelik bu bilgiyi anında uygulayarak, tabloyu kendileri oluşturmuş, özelliklerle ilişkilendirmiştir. Böylece daha mantıklı ve kalıcı bir öğrenim sağlanmıştır. Periyodik Tablo Son Test (PTKT-S) sonuçları ayrıntılı olarak incelendiğinde, deney grubu öğrencilerinin hemen tümünün doğru cevap verdiği bazı sorulara, kontrol grubu öğrencilerinin çok azının doğru cevap verebildiği, bazılarına hiç cevap veremediği görülmüştür. Kontrol grubunda saptanan başlıca eksik kavramalar aşağıdaki gibidir: 1. He atomunun niçin 2A grubu elementi değil, 8A grubu elementi olduğunu bilemedikleri, 2. Geçiş elementlerinin neden 2A grubundan sonra ve 4. periyotta başladığını bildikleri, ancak nedenini açıklayamadıkları, 3. B grubu elementlerinin niçin 1B grubu ile değil de, 3B grubu ile başladığını bilemedikleri, 4. Geçiş elementlerinin yer aldığı d bloğunda 10 tane dikey sütun olduğunu bildikleri, ancak bunu atomun yapısı ile ilişkilendiremedikleri, 5. Periyodik cetveldeki s, p, d, f bloklarında bulunan grup (element) sayılarını, atom orbitallerinde bulunabilecek maksimum elektron sayısı ile ilişkilendiremedikleri, 6. Periyot numarasının atomdaki enerji seviyesi, grup numarasının dış katmandaki elektron sayısı ile ilgilisini kavrayamadıkları, 7. Atom çapının periyodik tabloda nasıl değiştiğini doğru söyleyebilmelerine karşın, bunun nedenini açıklayamadıkları, 8. Bir periyotta, soldan sağa doğru gidildikçe iyonlaşma enerjisinin artacağını bilmelerine karşın, 2A ve 5A elementlerinin iyonlaşma enerjilerinin, beklenen değerden neden sapma, 9. Değerlik elektron sayısını elementin elektron dağılımının en son orbitalindeki elektron sayısı olarak bilmelerine, elementin bulunduğu bloğu da bilmelerine karşın, elementin bulunduğu bloktaki elektron sayısını değerlik elektron sayısı olarak ifade ettikleri, 10. Metal ve ametal özelliği gösteren elementlerin periyodik cetvelde yerini bilmelerine karşın, bu özelliklerin kendi içlerinde nasıl değiştiğini yorumlayamadıkları, 11. Periyodik tabloda grup ve periyot sayısı bilinen bir elementin ne gibi özelliklere sahip olduğunu tam olarak yorumlayamadıkları saptanmıştır. Öğretim sonunda, önerdiğimiz öğretim yöntemiyle ders işlenen grubun, geleneksel öğretim yöntemiyle ders işlenen gruba göre, özellikle yorum sorularında -büyük bir farkla- başarı sağladığı görülmüştür. Bu da geleneksel öğretim yönteminin ezbere dayalı bir yöntem olduğunun kanıtıdır. Sonuçta önerdiğimiz yeni yaklaşım başarılı olmuştur. Kaynakça Ausubel, D.P. (1963). The Psychology of Meaningful Verbal Learning . New York: Grune. Bodner, G.M., Klobuchor, M. Gleelan, D. (2001). The many Forms of Constructivism , Journal of Chemical Education 78(8), 1107 Burns,J.C., Okey, S.R., Wise, K.C. (1986). Development of an Integrated Process Skill Test , TIPS II Journal of Research in Science Teaching 22 (2), 169-177. Büyüköztürk, Ş., (2002). Sosyal Bilimler İçin Veri Analizi El Kitabı: İstatistik Araştırma Deseni, SPSS Uygulamaları ve Yorum . Pegem Yayıncılık, Ankara / Türkiye. Campbell, J., (1989), Let Us Make the Table Periodic , Journal of Chemical Education , 66(9), 739-740 Chandran, S.,Treagust, D. And Tobin, K. (1987). The Role of Cognitive Factors in Chemistry Achievement . Journal of Research in Science Teaching , 24, 145-160. Driver, R., Oldham V. (1986). A Constructivist Approach to Curriculum Development , Studies in Science Education 13, 105-122. Fernelius, W.R., Powel W.H, (1982). Confusion in the Periodic Table of the Elements , Journal of Chemical Education , 59(6), 504-508 Fernelius, W. C., (1986). Some Reflection on the Periodic Table and its Use , Journal of Chemical Education , 63(3), 263-266. Gagne, R. M. (1985). The Conditions of Learning and Theory of Instruction , New York: Holt, R. And Winston. Gorin, G., (1996). Mendeleyev and Moseley: The Principal Discoverers of Periodic Law , Journal Chemical Education , 73(5),490-49. Jack, E., (1985). Group Notation Revised in Periodic Table , Chemical-and-Engineer , 63(3), 25-27 Jonurs, M., (1982). Use Periodic Chart . Chem-13-News, 134(3), 15-16. Karaca, F. (2002). Lise 1 Kimya Ders Kitabı . Paşa Yayıncılık. Lehman, R. J., (1984). Interaction of Learner Characteristics with Learning from Three Models of the Periodic Table , Journal of Research in Science Teaching , 21(9), 885-889. Leoning, K.L., (1983). Recommended Format for the Periodic Table of the Elements , Journal of Chemical Education , 61(2), 136. Onwuegbuzie, A.J. (2000). Science Process Skill and Achievement in Research Methodology Courses . Bowling Green: Annual Meeting of the Mid-South Educational Research Association Osorio, M. V. H., (1990). A Numerical Periodic Table and f-Series Chemical Elements , Journal of Chemical Education , 67(7), 563-565. Postner, G. J., Strike, K. A., Hevson, P.W., and Gertzog, W. A. (1982). Accommodation of a Scientific Conception: Toward a Theory of Conceptual Change , Science Education , 66(2), 211-227. Roger, C. M., (1982). Why Teach the Electron Configuration of the Elements as We Do? , Journal of Chemical Education , 59(9), 757. Rosenshine,B., (1987). Explicit Teaching , D.Berliner and B.Rosenshine. (Eds) Talks to Teachers, New york, Random House. Senemoğlu, N., (1998). Gelişim, Öğrenme ve Öğretim . Ankara: Gazi Kitapevi . Strong, A. J., (1986). The Periodic Table and Electron Configurations , Journal of Chemical Education , 63(10), 834. Stuessy, C., (1984). Correlates of Scientific Reasoning in Adolescents: Experience, Locus of Control, Age, Field, Dependence-Independence, Rigidity/Flexibility, IQ and Gender , Doctoral Dissertation, Columbus, Ohio: The Ohio State University Tezcan, H., Günay, S. (2003). Lise Kimya Öğretiminde Laboratuvar Kullanımına ilşkin Öğretmen görüşleri . Millî Eğitim Dergisi , 159, 195-201. Tobin, K., (1990). Research on Science Laboratory Activities: In Pursuit of Better Questions and Answers to Improve Learning , School Science and Mathematics , 90(5), 403-418. White,R. T. (1993). Learning Science . Oxford: Blackwell Publishers. Yager, R.E.,(1991). The Constructivist Learning Model, Science Teacher , 56(6),52-57.
Abstract This study was carried out on the first year high school students studying in Private Güneşli high school in Bağcılar district of Istanbul. The Periodic Table of Elements was selected as the subject which the students have difficulty to understand. Two classes with equal success rate were chosen and were assigned one of them as the Control and the other as the Experimental group. Both groups were subjected to Scientific Process Skill Test before education process in order to determine the effect of scientific process skills upon their comprehension. The Conceptual Test with 20 questions was prepared. This test was subjected to both groups as a Pre-Test in order to determine their prior knowledge before the teaching process and as a Final Test in order to measure their success after the teaching process. The topic was studied to the control group by the Traditional Method and studied to the experimental group by the a New Approach. The datum were evaluated with t-Test. The new approach was determined more successful compared with the traditional method. Key Words: The periodic table, teaching periodic table at high schools
|